Physik → Atomphysik →
Quantenzahlen, Pauli-Prinzip und Zuteilung von Elektronen
Quantenzahlen
Nicht alle Messgrößen der Quantenmechanik haben einen wohlbestimmten Wert. Bei denen, welche einen besitzen, wird der Zustand zu der Messgröße als Eigenzustand und der wohlbestimmte Wert als Eigenwert bezeichnet. Einem solchen Zustand kann eine Quantenzahl zugeschrieben werden. Im Folgenden werden alle Quantenzahlen aufgeführt, welche zur vollständigen Beschreibung eines Elektrons im Wasserstoff-Atom benötigt werden.
|
Name |
Symbol |
Mögliche Werte |
Bedeutung |
|
Hauptquantenzahl |
Schale / Hauptenergieniveau, Bezeichnung: K, L, M, N … |
||
|
Bahnquantenzahl (auch Drehimpulsquantenzahl / Nebenquantenzahl) |
Form des Orbitals, Bezeichnung: s für |
||
|
Magnetische Quantenzahl des Bahndrehimpulses |
Räumliche Orientierung des Elektronen-Bahndrehimpulses |
||
|
Spinquantenzahl |
Eigendrehimpuls des Elektrons |
Pauli-Prinzip
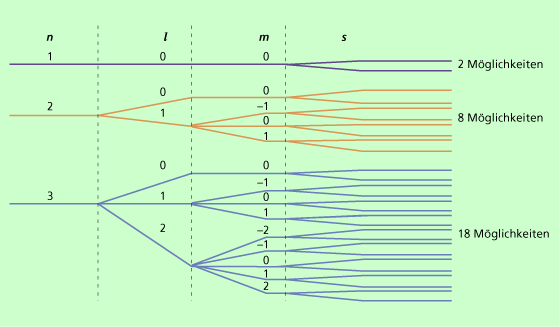
Keine zwei Elektronen des Atoms können in allen vier Quantenzahlen übereinstimmen.
Aus diesem Satz folgen die möglichen Anzahlen von Elektronen in Schalen, wie dieses Schema zeigt.
Für die maximale Anzahl von Elektronen in einer Schale gilt:
Hieraus folgt auch die Zuteilung von Elektronen in Schalen.
Zuteilung von Elektronen
Befüllen nach Schalen
Die Schalen werden von unten aufgefüllt, wobei die maximale Besetzung einer Schale nach den Quantenzahlen und dem Pauli-Prinzip mit berechnet wird. Für die untersten vier Schalen ergibt sich:
|
Schale |
Anzahl der Elektronen |
|
K |
2 |
|
L |
8 |
|
M |
18 |
|
N |
32 |
Die Anzahl der Elektronen folgt aus der Ordnungszahl, in der äußersten Schale können sich höchstens 8 Elektronen befinden.
Befüllen der Orbitale (Elektronenkonfiguration)
Nach dem Orbitalmodell befinden sich die Elektronen eines Atoms in bestimmten Aufenthaltsräumen -- den Orbitalen. Aufgrund des Pauli-Prinzips befinden sich in jedem Orbital maximal nur zwei Elektronen (nur die Spinquantenzahl kann sich unterscheiden und nur zwei Werte annehmen).
Die Orbitale werden nach ihrem Energieniveau unterschieden. Befinden sich beispielsweise drei Orbitale auf einem Energieniveau, so sind dies p-Orbitale.
|
Bezeichnung |
Anzahl der Orbitale auf einem Energieniveau |
|
s |
1 |
|
p |
3 |
|
d |
5 |
|
f |
14 |
Innerhalb eines Energieniveaus werden die Orbitale nach der Hundschen Regel normalerweise erst alle einfach und danach doppelt besetzt.
Die Besetzung geschieht normalerweise nach diesem Energieschema.
Notation
Nummer der Schale, dann Buchstabe der Unterschale (Energieniveau), dann hochgestellt die Anzahl der Elektronen in der Unterschale.
Beispiel:
So ergibt sich für die eine mit 5 Elektronen besetzte p-Unterschale der 3. Schale die Schreibweise
Bei mehreren Unterschalen kann zudem die gemeinsame Schale weggelassen werden:
Beispiel Chlor: 1s2 2s2 2p6 3s2 3p5
Eine andere mögliche Darstellung für Elektronenkonfigurationen ist die Kästchenschreibweise.
Sie möchten mir einen Kaffee spendieren?
Anmerkungen oder sonstige Ideen und Vorschläge können Sie gern per Mail an info@lernzettel.org bzw. fehler@lernzettel.org senden.