Chemie → Kunststoffe →
Polymerisation
Neben der bereits kennengelernten Polykondensation können Polymere auch durch Polymerisation gebildet werden.
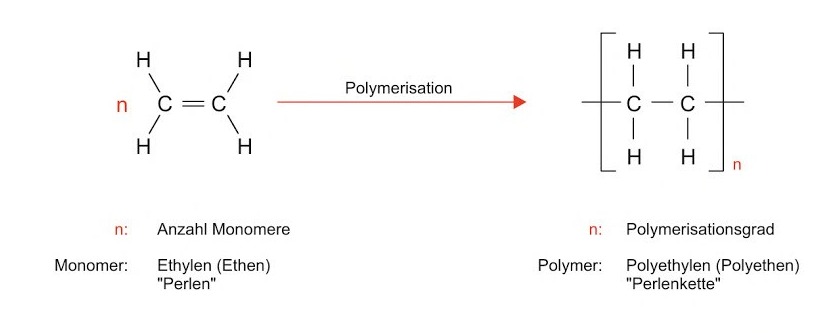
Bei der Polymerisation (IUPAC-konform Kettenpolymerisation) verbinden sich Monomere (ausgehend von einem Startpunkt bis zum Abbruch), welche mindestens eine Doppelbindung besitzen (ungesättigt), zu Polymeren. Die Reaktion läuft hierbei anders als bei der Polykondensation ohne Abspaltung von Nebenprodukten und zudem ohne Atomwanderungen ab. Es brechen jeweils die Doppelbindungen auf und eine Kohlenstoffkette wird gebildet. Wie viele Monomere hierbei insgesamt verbunden werden bestimmt den Polymerisationsgrad n.
So lässt sich für die Polymerisation im Allgemeinen folgendes Schema aufstellen:
Quelle der Grafiken: Quellen
Der Kettenaufbau ist vom reaktiven Zentrum (Radikal, Anion, Kation) abhängig, sodass in mehrere Kategorien von Kettenpolymerisationen unterschieden wird:
- radikalische Polymerisation
- kationische Polymerisation
- anionische Polymerisation
Hierbei teilen alle Kettenpolymerisationen einen ähnlichen Vorgang, welcher folgende Schritte enthält:
- Startreaktion
- Kettenreaktion
- Abbruchreaktion
Radikalische Polymerisation
Wiederholung zu den Radikalen:
Radikale sind Moleküle beziehungsweise Atome mit mindestens einem ungepaarten Valenzelektron und somit besonders reaktionsfreudig.
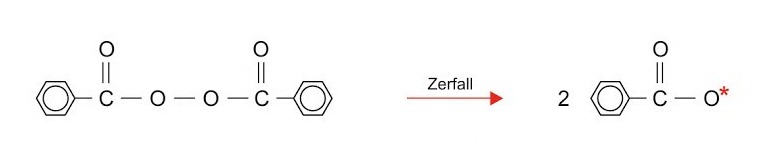
Diese Radikale können durch elektromagnetische Strahlung entstehen, allerdings werden häufig Initiatoren verwendet, die bei geringer Temperaturerhöhung (zwischen 40°C und 100°C[1]) in Radikale zerfallen. So ist der erste Schritt der radikalischen Polymerisation die Bildung des Initiators (Radikal).
Ein Beispiel hierfür ist Dibenzolperoxid:
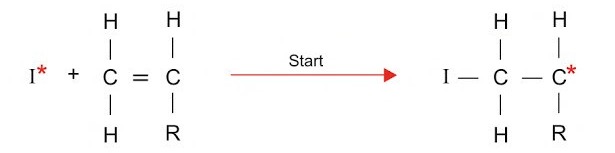
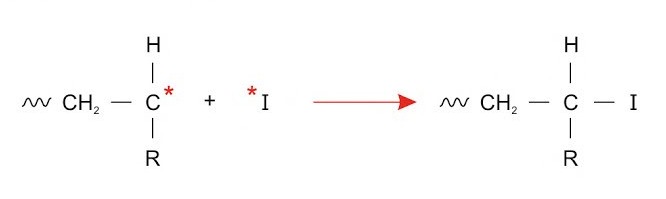
Nun ist der Initiator gebildet und die Startreaktion kann folgen, wobei der Initiator im Folgenden mit I abgekürzt wird. In der Startreaktion wird die Doppelbindung des Monomers beziehungsweise des Ethenderivats (mit Rest, bei Ethen H) durch das Radikal aufgebrochen, sodass dieses ebenfalls zum Radikal wird, welches an beiden Kohlenstoffatomen ein ungepaartes Valenzelektron besitzt. Eines der ungepaarten Valenzelektronen bindet daraufhin mit dem ungepaarten Valenzelektron des Initiators, eine Einfachbindung entsteht. Das ungepaarte Valenzelektron am anderen Kohlenstoff bleibt.
Der gleiche Prozess wie am Initiator kann sich durch das ungepaarte Valenzelektron in der folgenden Kettenreaktion immer wieder wiederholen, sodass sich ein Polymer bildet.
Das Wachstum des Polymers wird durch eine Abbruchreaktion beendet, wobei diese in zwei verschiedenen Weisen auftreten kann.
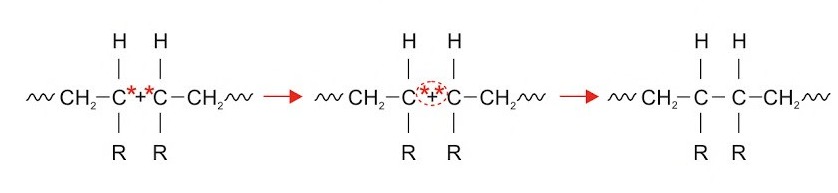
1. Rekombination
Hier verbinden sich zwei Ketten miteinander. Die ungepaarten Valenzelektronen an den Enden binden und die Reaktion ist beendet.
2. Initiatorreaktion
Auch ein Initiator kann mit seinem ungepaarten Valenzelektron eine Bindung zu einer Kette eingehen.
Falls es sich bei dem Rest um Wasserstoff oder eine Kohlenwasserstoffverbindung handelt, so kann eine saubere Verbrennung zu Kohlenstoffdioxid und Wasser geschehen. Doch der Rest kann (wie beim Polyvinylchlorid (PVC)) auch zum Beispiel Chlor sein und hieraus resultierend für Gesundheitsgefahren sorgen.
Kettenübertragung
Besonders bei höheren Reaktionstemperaturen kann es dazu kommen, dass Alkylradikale Wasserstoffatome von der wachsenden Kette abspalten. Es entsteht ein neues Radikal, welches sich allerdings nicht am Ende der Kette befindet, von welchem Kettenwachstum ausgehen kann, sodass sich Verzweigungen bilden. Dies spielt besonders bei der Herstellung von Pfropfcopolymeren eine Rolle. Die Struktur von Hochdruckpolymeren weist deswegen eher Verzweigungen auf als die von Niederdruckpolymeren. Hieraus folgt auch ein Unterschied in den Eigenschaften. Bei dem Niederdruckverfahren entstehen aufgrund der wenigeren Verzweigungen eher Polymere höherer Dichte (zum Beispiel HDPE à high density polyethylen) und bei dem Hochdruckverfahren (mit höherer Temperatur) aufgrund der vielen Verzweigungen eher Polymere niedrigerer Dichte (zum Beispiel LDPE à low density polyethylen). Je verzweigter die Polymere, desto amorpher und weniger kristallin sind sie und besitzen somit eine geringere Dichte. (Hausaufgabe)
Kationische Polymerisation
Bei der kationischen Polymerisation wirkt ein Kation (H+) als Starter und ein Anion als Abbrecher. In der Startreaktion bindet das Kation an das Monomer, indem die Doppelbindung aufklappt. Hierdurch bildet sich ein Carbeniumion (C+), von welchem die weitere Polymerisation beginnt. Abgebrochen werden kann hier weder durch eine andere Kette, noch durch einen Starter, sondern durch ein Anion.
Anionische Polymerisation
Als Starter fungiert ein Anion, ein Carbanion (C-) bildet sich in der Startreaktion, beendet wird die Reaktion durch ein Kation.
// Die kationische und anionische Polymerisation wurden nur der Vollständigkeit halber hinzugefügt (diese wurden im Unterricht nur kurz angesprochen).
// Die Erarbeitung geschah im Unterricht durch einen Lehrfilm und das hierauf folgende Bearbeiten und Besprechen eines Arbeitszettels zur Bildung von Polyethylen.
Quellen
Alle Grafiken stammen aus: Kaiser, Wolfgang: Kunststoffchemie für Ingenieure: Von der Synthese bis zur Anwendung
https://www.hanser-fachbuch.de/technik/kunststofftechnik/
Insgesamt diente dieses Chemiebuch neben elementechemie 2 als Hauptquelle.
Weitere Onlinequellen:
https://www.lernhelfer.de/schuelerlexikon/chemie/artikel/polymerisation
(Abgerufen am 14.11.2018 um 19:41)
https://de.wikipedia.org/wiki/Polyethylen
(Abgerufen am 14.11.2018 um 19:41)
[1] Nach Kaiser, Wolfgang: Kunststoffchemie für Ingenieure: Von der Synthese bis zur Anwendung (S. 43)
Sie möchten mir einen Kaffee spendieren?
Anmerkungen oder sonstige Ideen und Vorschläge können Sie gern per Mail an info@lernzettel.org bzw. fehler@lernzettel.org senden.